
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | KCl、Na2SO4 | B. | KCl、Na2SO4、NaCl | ||
| C. | NaCl、K2SO4 | D. | KCl、K2SO4、Na2SO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol臭氧和1.5 mol氧气含有相同的氧原子数 | |
| C. | 等体积、浓度均为1 mol•L-1的磷酸和盐酸,H3PO4和HCl含有的氢元素质量之比为1:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.查看答案和解析>>
科目: 来源: 题型:解答题
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
查看答案和解析>>
科目: 来源: 题型:解答题
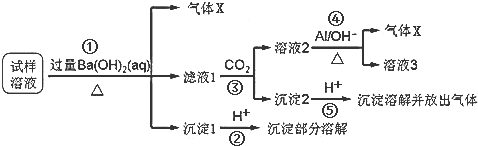
查看答案和解析>>
科目: 来源: 题型:解答题
 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| B. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++H++OH-+SO42-=BaSO4↓+H2O | |
| C. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO3- | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com