
科目: 来源: 题型:选择题
| A. | Fe3+ Na+ S2- Cl- | B. | Al3+ NH4+ AlO2- NO3- | ||
| C. | NH4+ Mg2+ SO42- Cl- | D. | H+ Na+ HCO3- SiO32- |
查看答案和解析>>
科目: 来源: 题型:填空题

 ,反应类型加聚反应;
,反应类型加聚反应;
 .
.查看答案和解析>>
科目: 来源: 题型:填空题
 在一容积为2L的密闭容器内为加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:
在一容积为2L的密闭容器内为加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:查看答案和解析>>
科目: 来源: 题型:填空题
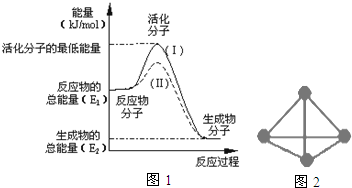
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题


查看答案和解析>>
科目: 来源: 题型:填空题
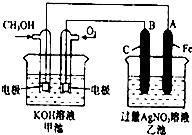 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Va>Vb时:c (CH3COOH)+c (CH3COO-)>c (K+) | |
| B. | Va=Vb时:c(CH3COOH)+c (H+)=c(OH-) | |
| C. | Va<Vb时:c(CH3COO-)>c (K+)>c(OH-)>c(H+) | |
| D. | Va与Vb任意比时:c(K+)+c (H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
科目: 来源: 题型:选择题
 用铅蓄电池(总反应:2PbSO4+2H2O$?_{放电}^{充电}$ Pb+PbO2+4H++2SO42- )电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池(总反应:2PbSO4+2H2O$?_{放电}^{充电}$ Pb+PbO2+4H++2SO42- )电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池放电时的正极反应是:PbO2+4H++SO42-═PbSO4+2H2O | |
| B. | 电解苦卤水时,a 电极首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl- | |
| C. | 铅蓄电池充电时,A极应与外接电源负极相连 | |
| D. | 忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01 molH2SO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 饱和NaCl溶液中通入HCl气体有晶体析出 | |
| C. | 500℃左右比室温更有利于合成氨反应 | |
| D. | 滴有酚酞试液的氨水中加入少量醋酸铵晶体,溶液红色变浅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com