
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
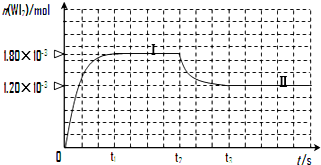 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)
碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)查看答案和解析>>
科目: 来源: 题型:填空题
 科学家预言,燃料电池将是21世纪获得电能的重要途径.
科学家预言,燃料电池将是21世纪获得电能的重要途径.查看答案和解析>>
科目: 来源: 题型:填空题
 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
 按要求对图中两极进行必要的联接并填空:其中a.b为惰性电极
按要求对图中两极进行必要的联接并填空:其中a.b为惰性电极查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
 按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )
按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解池将化学能转化为电能 | |
| B. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| C. | 用惰性电极电解饱和NaCl溶液一段时间后,若 通入氯化氢气体,能使电解液恢复到原状态 | |
| D. | 用惰性电极电解Na2SO4溶液,阴阳两极气体产物的物质的量之比为1:2 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 电子沿着盐桥从锌电极流向铜电极 | |
| B. | 盐桥中的阳离子向硫酸铜溶液中迁移 | |
| C. | 电流从锌电极通过电流计流向铜电极 | |
| D. | 铜电极上发生的电极反应是2H++2e-═H2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
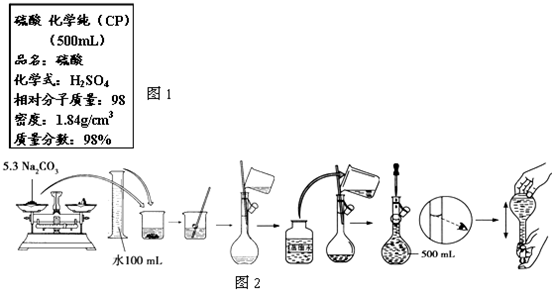
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com