
科目: 来源: 题型:选择题
| A. | Fe3+ SCN-Na+ NO${\;}_{3}^{-}$ | B. | Cu2+ SO${\;}_{4}^{2-}$HCO${\;}_{3}^{-}$K+ | ||
| C. | CO${\;}_{3}^{2-}$Na+Cl-K+ | D. | Ba2+ Ca2+ Cl-NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目: 来源: 题型:解答题



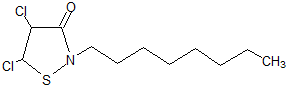 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目: 来源: 题型:解答题
 ,X属于共价化合物.Y的电子式是
,X属于共价化合物.Y的电子式是 ,Y属于离子化合物.Y中含有的化学键类型有离子键、共价键.
,Y属于离子化合物.Y中含有的化学键类型有离子键、共价键. .
.查看答案和解析>>
科目: 来源: 题型:填空题
 .
.
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 反应的化学方程式是
反应的化学方程式是
查看答案和解析>>
科目: 来源: 题型:解答题
 ,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形.
,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形.查看答案和解析>>
科目: 来源: 题型:解答题
 ,它是F-离子.1mo1B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是Al;B的最高价氧化物的对应水化物的化学式为Al(OH)3.C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是SC与Na反应后生成物的电子式为
,它是F-离子.1mo1B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是Al;B的最高价氧化物的对应水化物的化学式为Al(OH)3.C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是SC与Na反应后生成物的电子式为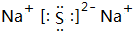 ,化合物中的化学键属于离子键.
,化合物中的化学键属于离子键.查看答案和解析>>
科目: 来源: 题型:解答题
 某学生用0.1000mol/L KOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.1000mol/L KOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com