
科目: 来源: 题型:阅读理解
| 实验操作 | 实验现象 | |
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份. | 有少量气泡产生,溶液的黄绿色褪去. |
| 步骤2 | 将第一份滤液与稀盐酸混合. | 产生大量气泡. |
| 步骤3 | 将第二份滤液加热. | 溶液变浑浊,且有大量无色气体产生. |
查看答案和解析>>
科目: 来源: 题型:阅读理解
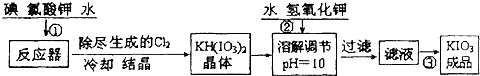
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
| O | 2- 3 |
| O | 2- 6 |
| 1270 |
| 3W |
| 1270 |
| 3W |
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
查看答案和解析>>
科目: 来源: 题型:
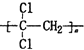 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由 )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下.
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下.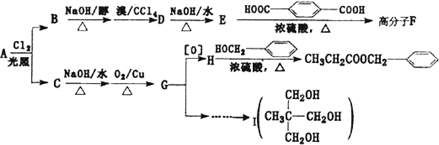
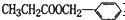 互为同分异构体的是
互为同分异构体的是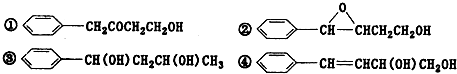


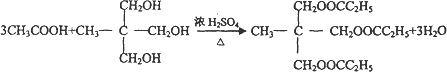

查看答案和解析>>
科目: 来源: 题型:

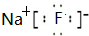
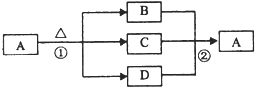
查看答案和解析>>
科目: 来源: 题型:
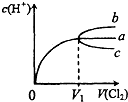 (2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
(2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
(2010?和平区一模)提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com