
科目: 来源: 题型:多选题
 将N2,H2按物质的量比为1:3的比例混合于5L的恒容密闭容器中进行反应N2+3H2?2NH3,△H<0,若该反应的逆反应速率随时间变化的关系如图所示.则t1时改变的条件不可能是( )
将N2,H2按物质的量比为1:3的比例混合于5L的恒容密闭容器中进行反应N2+3H2?2NH3,△H<0,若该反应的逆反应速率随时间变化的关系如图所示.则t1时改变的条件不可能是( )| A. | 升温 | B. | 使用催化剂 | C. | 加入一定量NH3 | D. | 加入一定量N2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由$\stackrel{-1}{Cl}$转移$\stackrel{+5}{Cl}$,共6e- | B. | 由$\stackrel{-1}{Cl}$转移$\stackrel{+5}{Cl}$,共5e- | ||
| C. | 由$\stackrel{0}{Cl}$转移$\stackrel{+5}{Cl}$,共6e- | D. | 由$\stackrel{0}{Cl}$转移$\stackrel{+5}{Cl}$,共5e- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3:8 | B. | 32:21 | C. | 21:32 | D. | 21:8 |
查看答案和解析>>
科目: 来源: 题型:解答题
 为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下:
为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

 ,丁分子的结构式为H-$\stackrel{\stackrel{H}{/}}{N}$-$\stackrel{\stackrel{H}{/}}{N}$-H,丙属于极性分子(填“极性”或“非极性”)
,丁分子的结构式为H-$\stackrel{\stackrel{H}{/}}{N}$-$\stackrel{\stackrel{H}{/}}{N}$-H,丙属于极性分子(填“极性”或“非极性”)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度,固体的量减少 | |
| B. | 加入少量Na2CO3粉末能增大钙离子的浓度 | |
| C. | 恒温下加入少量CaO,溶液的pH增大 | |
| D. | 降低温度,溶液中c(OH-)增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
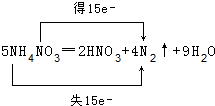
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3NO2+H20═2HNO3+NO,转移3e- | |
| B. | 2KMnO4+10FeSO4+8H2SO4═K2SO4+5Fe2(SO4)3+2MnSO4+8H20,转移5e- | |
| C. | KClO3+6HCl═KCl+3Cl2↑+3H20,转移6e- | |
| D. | I2+SO2+2H20═H2SO4+2HI,转移2e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com