
科目: 来源: 题型:填空题

 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
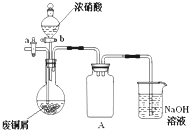 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
科目: 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
查看答案和解析>>
科目: 来源: 题型:解答题
 苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
| 物质 | 相对分子 质量 | 密度/ (相对于水) | 沸点/℃ | 溶解性 |
| 苯甲醛 | 106 | 1.046 | 178.8 | 微溶于水,可混溶于乙醇、乙醚、苯、氯仿 |
| 苯甲醇 | 108 | 1.042 | 205.7 | 溶于水,易溶于乙醇、醚、芳烃 |
| 苯甲酸 | 122 | 1.271 | 249.2 | 微溶于水,易溶于乙醇、乙醚、氯仿、苯、二硫化碳、四氯化碳 |
| 苯甲酸钠 | 144 | 1.442 | 249.3 | 溶于水和乙醇、甘油、苯、甲醇、微溶于乙醚 |
| 温度/℃ | 25 | 50 | 95 |
| 溶解度/g | 0.17 | 0.95 | 6.8 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 在水中溶解性 |
| 甲苯 | -95 | 110.6 | 0.8669 | 难溶 |
| 苯甲酸钾 | 121.5~123.5 | 易溶 | ||
| 苯甲酸 | 122.4 | 248 | 1.2659 | 微溶 |
查看答案和解析>>
科目: 来源: 题型:解答题
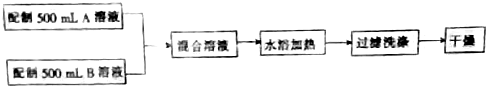
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com