
科目: 来源: 题型:选择题
| A. | Ba(OH)2与H2SO4两稀溶液混合:Ba2++OH-+H++S042-═BaS04↓+H2O | |
| B. | AlCl3溶液中加入过量氨水:Al3++3NH3.HO═Al(OH)3↓+3NH4+ | |
| C. | 将Na投入到CuS04溶液:2Na+Cu2+═2Na++Cu | |
| D. | 等物质的量的MgCl2、NaOH和HCl溶液混合:Mg2++20H一═Mg(OH)2↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量的氨水Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 铝片投入硝酸汞溶液中:Al+Hg2+═Al3++Hg | |
| D. | 金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放热反应不需要加热就可以发生 | |
| B. | 反应条件为加热的反应都是吸热反应 | |
| C. | 化学反应放热还是吸热,取决于反应条件 | |
| D. | 化学反应除了生成新物质外,还伴随着能量的变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═Fe3++2Fe2++4H2O | |
| C. | 将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO${\;}_{3}^{-}$═Fe3++2H2O+NO↑ | |
| D. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目: 来源: 题型:解答题

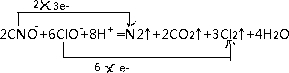 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,0.05mol•L-1Fe2(SO4)3溶液中含Fe3+数目为0.1NA | |
| B. | 1molFeCl3跟水反应完全转化成氢氧化铁胶体后,生成胶体粒子的数目为NA | |
| C. | 标准状况下,aL的氧气和氮气的混合物含有的原子数约为$\frac{a}{22.4}$×6.02×1023 | |
| D. | 常温常压下,8gO2含有4NA个电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com