
科目: 来源: 题型:解答题


 .
. 生成A的化学方程式为
生成A的化学方程式为 +O2$\stackrel{催化剂}{→}$
+O2$\stackrel{催化剂}{→}$ +HCHO.
+HCHO. +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.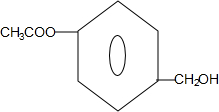 (任写一种结构简式).
(任写一种结构简式).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用明矾作净水剂:Al3++3H2O═Al(OH)3↓+3H+ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu═Fe2++Cu2+ | |
| D. | 含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原电池放电时,负极上发生反应的物质是Zn | |
| B. | 负极上发生的反应是Zn+2OH--2e-═Zn(OH)2 | |
| C. | 工作时,负极区溶液pH减小,正极区pH增大 | |
| D. | 溶液中OH-向正极移动,K+、H+向负极移动 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 25℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法正确的是( )
25℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法正确的是( )| A. | 醋酸的电离平衡常数:a<b<c | |
| B. | 溶液中n(H+):b>a>c | |
| C. | a、b、c三点的溶液都有:c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 从c点到b点,醋酸的电离度不断增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高一定的温度 | |
| B. | 加入100 mL 0.1 mol•L-1的醋酸溶液 | |
| C. | 加入少量的0.5 mol•L-1的硫酸 | |
| D. | 加入少量的1 mol•L-1的NaOH溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化硅的结构式:O=Si=O | |
| B. | H2O沸点高于NH3,是因为H2O分子间存在氢键而NH3分子间不存在氢键 | |
| C. | 含有金属离子的晶体一定是离子晶体 | |
| D. | 分子晶体中一定存在分子间作用力,不一定存在共价键 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验目的 | 主要仪器 | 试剂 | |
| A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )| A. | 反应在前50s的平均速率v(PCl5)=0.0032 mol•L-1•s-1 | |
| B. | 该反应的平衡常数K=0.025 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3 和0.20mol Cl2,反应达到平衡前v(正)>v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时:c(PCl3)=0.11mol•L-1,则反应的△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com