
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:
某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

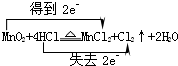 .
.| 实验操作 | 实验现象 | 结 论 |
| 向已褪色的溶液中加入适量NaOH溶液 | 溶液变红 | 假设①成立 |
| 溶液不变红 | 假设②成立 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 试剂 | T1/℃ | T2/℃ | T2/℃ |
| Ha2CO2 | 23.3 | 20.0 | 23.7 |
| HaCO2 | 18.5 | 20.0 | 20.8 |
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Ha2CO2 | 12.5g | 21.5g | 39.7g | 40.g |
| HaHCO2 | 8.1g | 9.6g | 11.1g | 12.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应①、②、③都是氧化还原反应 | |
| B. | 反应①中H2O2被还原 | |
| C. | 氧化性:KMnO4>O2 | |
| D. | 每生成1mol F2,上述反应共转移2mol电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 仪器 | 实验 |
| A | 制取蒸馏水 | 圆底烧瓶、冷凝管、锥形瓶、温度计、牛角管 |
| B | 由98%的浓硫酸配制250ml 1.5mol/L的稀硫酸 | 250mol容量瓶、量筒、胶头滴管、玻璃棒 |
| C | 实验室用MnO2与浓盐酸制取并收集氯气 | 酒精灯、铁架台(带铁夹、铁圈)、圆底烧瓶、导管、集气瓶 |
| D | 测定NaCl中混有KCl | 烧杯、玻璃棒、酒精灯、蓝色钴玻璃、铂丝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com