
科目: 来源: 题型:解答题

| 反应时间(min) | n(CO)(mol) | N(H2O)(mol) |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目: 来源: 题型:解答题
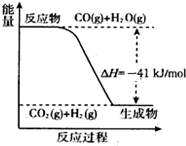 在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 |
| K | 2.6 | 1.7 | 1.0 | 0.9 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下:
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2+H2O
+KOH+2MnO2+H2O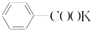 +HCl→
+HCl→ +KCl
+KCl
查看答案和解析>>
科目: 来源: 题型:解答题
 →合成→水热处理→过滤→水洗→表面处理→过滤水洗→干燥
→合成→水热处理→过滤→水洗→表面处理→过滤水洗→干燥查看答案和解析>>
科目: 来源: 题型:解答题
 某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{N/△}^{H_{2}}$CH3CH2CH2CH2OH
某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{N/△}^{H_{2}}$CH3CH2CH2CH2OH查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应的平衡常数表达式为k=$\frac{{c}^{3}(C)•c(D)}{{c}^{2}(A)•{c}^{3}(B)}$ | |
| B. | 升高温度,该反应的平衡常数增大 | |
| C. | 从反应开始10min,该反应的平均反应速率v(C)为0.12mol/(L•min) | |
| D. | B的平衡转化率为60% |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(SO2)(mol•L-1) | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 | 3.00×10-37 |
| c(CO)(mol•L-1) | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 | 2.00 |
| 实验 编号 | T(℃) | SO2初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂 |
| Ⅰ | 260 | 1.00 | 3.00 | Cr2O3 |
| Ⅱ | Fe2O3 | |||
| Ⅲ | 380 | |||
| Ⅳ | 4.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com