
科目: 来源: 题型:解答题
 ,分子中氮原子轨道的杂化类型是sp3.
,分子中氮原子轨道的杂化类型是sp3.查看答案和解析>>
科目: 来源: 题型:解答题
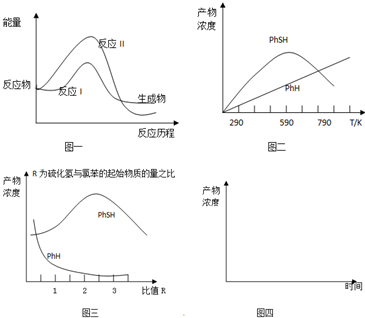
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
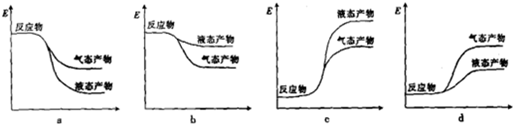
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
查看答案和解析>>
科目: 来源: 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com