
科目: 来源: 题型:解答题
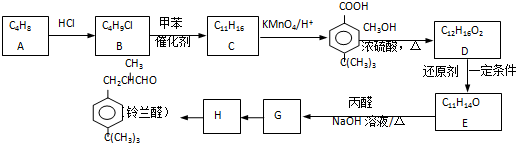


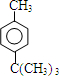 ;E
;E .
.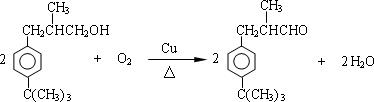 .
.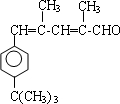 .
.查看答案和解析>>
科目: 来源: 题型:解答题
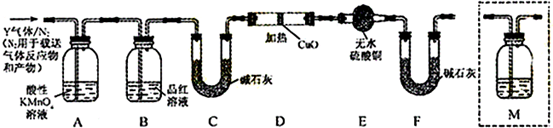
查看答案和解析>>
科目: 来源: 题型:解答题
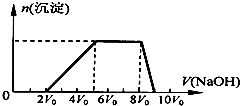 某混合溶液中可能含有的离子如表所示:
某混合溶液中可能含有的离子如表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n (Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n (Br-) | 3.0mol | 2.6mol | 1.6mol |
| n (I-) | x mol | 0 | 0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ④⑥⑦ | C. | ③④⑦ | D. | 以上都不正确 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入甲基橙试液呈红色的溶液 NH4+,K+,SO42-,Cl- | |
| B. | 饱和氯水中 Cl-、NO3-、Na+、SO32- | |
| C. | Na2S溶液中 SO42-、K+、Cl-、Cu2+ | |
| D. | pH=12的溶液中 NO3-、I-、Na+、Al3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 80mL 10mol•L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA | |
| B. | 2 L0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 标准状况下,11.2LSO3所含的分子数大于0.5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向氯化铝溶液中加入过量稀氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 向小苏打溶液中加入醋酸溶液:HCO3-+CH3COOH═CH3COO-+CO2↑+H2O | |
| C. | 苯酚钠溶液中通入二氧化碳CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| D. | 向溴化亚铁溶液中通入过量氯气Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Li在氧气中燃烧主要生成Li2O2 | |
| B. | 将SO2通入BaCl2溶液可生成BaS03沉淀 | |
| C. | 将Al 和MgO混合加热到高温可得到单质Mg | |
| D. | 将CO2通入次氯酸钙溶液可生成次氯酸 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:3.4 | B. | 1:1.7 | C. | 2.6:1 | D. | 4.6:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com