
科目: 来源: 题型:选择题
| A. | 在5 min内该反应用C表示的反应速率为0.02 mol•L-1•min-1 | |
| B. | 5 min时,容器内D的浓度为0.2 mol•L-1 | |
| C. | 当容器内压强保持恒定时,该可逆反应达到平衡状态 | |
| D. | 5 min时容器内气体总的物质的量为3 mol |
查看答案和解析>>
科目: 来源: 题型:填空题
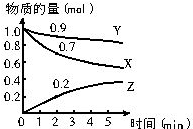
查看答案和解析>>
科目: 来源: 题型:解答题
 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,G为红棕色;②I是一种常见的温室气体,它和E可以发生反应:2E+I$\frac{\underline{\;点燃\;}}{\;}$ 2F+D,F中的E元素的质量分数为60%.回答问题:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,G为红棕色;②I是一种常见的温室气体,它和E可以发生反应:2E+I$\frac{\underline{\;点燃\;}}{\;}$ 2F+D,F中的E元素的质量分数为60%.回答问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当金属全部溶解时收集到NO气体的体积一定为2.24 L | |
| B. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL | |
| C. | 参加反应的金属的总质量3.6g<m<9.6 g | |
| D. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L | |
| C. | NO2和N2O4 的混合气体中,NO2的体积分数是80% | |
| D. | 该合金中铜与镁的物质的量之比是2:1 |
查看答案和解析>>
科目: 来源: 题型:解答题
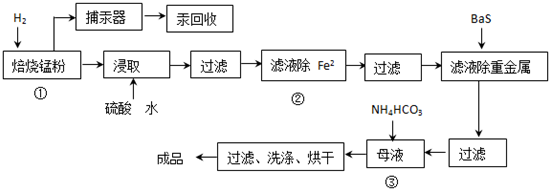
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 12种 | B. | 10种 | C. | 8种 | D. | 14种 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | N2(g)+3H2(g)?2NH3(g)△H<0 | B. | 2SO3(g)?2SO2 (g)+O2(g)△H>0 | ||
| C. | 4NH3(g)+5O2 (g)?4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
查看答案和解析>>
科目: 来源: 题型:解答题
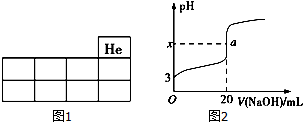 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.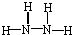 ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com