
科目: 来源: 题型:解答题
 甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:
甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
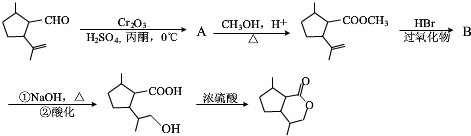
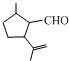 的分子式为C10H16O;其含有的含氧官能团名称是醛基.
的分子式为C10H16O;其含有的含氧官能团名称是醛基.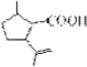 .
. .生成B物质的反应类型为:取代反应.
.生成B物质的反应类型为:取代反应.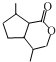 的同分异构体
的同分异构体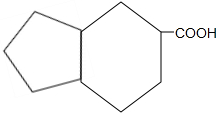 .(任写一种)
.(任写一种)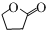 的合成路线图(无机试剂任选),合成路线流程图如下:
的合成路线图(无机试剂任选),合成路线流程图如下: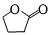
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化铵和碘都可以用加热法进行提纯 | |
| B. | 铜和氯化钠溶液均能导电 | |
| C. | 硫酸亚铁溶液和氢氧化钠溶液在空气中留置均会变质 | |
| D. | 铁片和铝片置于冷的浓硫酸中均无明显现象 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
 ,产物的结构简式为
,产物的结构简式为 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | pH=3的H2SO4溶液中:c(H+)=10-3mol•L-1 | |
| B. | 呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 在Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 氯化铵溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol•L-1NaHCO3溶液中的Na+数为NA | |
| B. | 常温时,4.4gCO2所含的氧原子数为0.2NA | |
| C. | 5.6g Fe与足量稀硝酸反应,转移电子数为0.2NA | |
| D. | 1molNa 与O2 反应生成Na2O2和Na2O电子转移数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:填空题
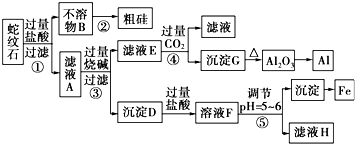
查看答案和解析>>
科目: 来源: 题型:填空题
 的合成路线如图(部分反应条件省略)
的合成路线如图(部分反应条件省略)
 (注明反应的条件).
(注明反应的条件). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com