
科目: 来源: 题型:解答题
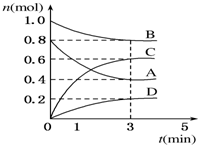 T℃时,在容积为0.5L的密闭容器中发生如 下反应.mA(g)+nB(g)?pC(g)+qD(s)△H<0(m、n、p、q为最简整数比).A、B、C、D的物质的量变化如图所示.
T℃时,在容积为0.5L的密闭容器中发生如 下反应.mA(g)+nB(g)?pC(g)+qD(s)△H<0(m、n、p、q为最简整数比).A、B、C、D的物质的量变化如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: +HO2+H2SO4$\stackrel{100-130℃}{→}$
+HO2+H2SO4$\stackrel{100-130℃}{→}$ +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O )到硫酸溶液中,然后升温至130℃继续反应,仪器c的名称是球形冷凝管.反应结束后加适量冷水,再分离出苯乙酸(
)到硫酸溶液中,然后升温至130℃继续反应,仪器c的名称是球形冷凝管.反应结束后加适量冷水,再分离出苯乙酸( )粗品.加入冷水的目的是便于苯乙酸析出.
)粗品.加入冷水的目的是便于苯乙酸析出.查看答案和解析>>
科目: 来源: 题型:填空题
| 选项 | 甲 | 乙 |
| A | 物质的粒子数 | 阿伏加德罗常数 |
| B | 标况下气体的体积 | 标况下气体摩尔体积 |
| C | 固体的体积 | 固体的密度 |
| D | 溶液的物质的量浓度 | 溶液的体积 |
查看答案和解析>>
科目: 来源: 题型:选择题
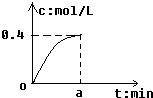 反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 0.1 | B. | 2.5 | C. | 5 | D. | 10 |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )| A. | T1<T2 p1>p2 m+n>p 放热反应 | B. | T1>T2 p1<p2 m+n>p 吸热反应 | ||
| C. | T1<T2 p1>p2 m+n<p 放热反应 | D. | T1>T2 p1<p2 m+n<p 吸热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| B. | 红棕色的NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | H2、I2、HI平衡时的混合气体加压后颜色变深 |
查看答案和解析>>
科目: 来源: 题型:解答题
 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电池.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电池.甲醇燃料电池的工作原理如图所示. 查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | H-H | C-O | C$\stackrel{←}{=}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com