
科目: 来源: 题型:解答题
 +H2O2
+H2O2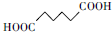 +H2O
+H2O
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值减小 | |
| C. | 醋酸的电离程度增大,[H+]亦增大 | |
| D. | 再加入10mlpH=11的NaOH溶液,混合液pH=7 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题

| 尾 气 吸 收 装 置 |  |  |
| 处理气体 | ①③ | ②④ |
查看答案和解析>>
科目: 来源: 题型:填空题
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.查看答案和解析>>
科目: 来源: 题型:解答题
 .写出B的试管中所发生反应的化学方程式HBr+AgNO3=AgBr↓+HNO3.
.写出B的试管中所发生反应的化学方程式HBr+AgNO3=AgBr↓+HNO3.
查看答案和解析>>
科目: 来源: 题型:解答题
 某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目: 来源: 题型:解答题
 安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,对二氧化硫的排放有了大大的改善.已知SO2可以用Fe( NO3)3溶液吸收,0.1mol/L的Fe(NO3)3溶液的pH=2某学习小组据此展开如下相关探究:
安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,对二氧化硫的排放有了大大的改善.已知SO2可以用Fe( NO3)3溶液吸收,0.1mol/L的Fe(NO3)3溶液的pH=2某学习小组据此展开如下相关探究:查看答案和解析>>
科目: 来源: 题型:填空题
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的组装如图反应装置,过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的组装如图反应装置,过程如下: .
.查看答案和解析>>
科目: 来源: 题型:解答题
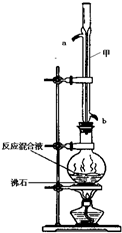 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com