
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑤⑦ | C. | ①④⑦ | D. | ③⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:解答题
 氨气是一种重要工业原料,在工农业生产中具有重要的应用.
氨气是一种重要工业原料,在工农业生产中具有重要的应用.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol ${\;}_{8}^{16}$OD-离子含有的质子、中子数均为10NA | |
| B. | 标准状况下,4.48 L己烷含有的分子数为0.2NA | |
| C. | 含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA | |
| D. | VL a mol•L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目等于3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
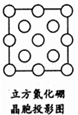 太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.查看答案和解析>>
科目: 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.查看答案和解析>>
科目: 来源: 题型:选择题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol N2、3mol H2 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ |
| 气体密度 | ρ1 | ρ2 |
| 反应物转化率 | α1 | α2 |
| A. | c1<c2<2c1 | B. | a+b>92.4 | C. | α1+α 2=1 | D. | ρ2=3ρ1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com