
科目: 来源: 题型:选择题
| A. | Ca(OH)2═Ca2++2OH- | B. | Al2(SO4)3═2Al3++3SO42- | ||
| C. | NH4Cl═NH3+H++OH- | D. | HNO3═H++NO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少;甲池中发生的反应为:CH4+2O2+2KOH═K2CO3+3H2O.回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少;甲池中发生的反应为:CH4+2O2+2KOH═K2CO3+3H2O.回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
 一种碳纳米管能够吸附氢气,用这种材料吸氢后制备的二次电池(充放电电池)工作原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料吸氢后制备的二次电池(充放电电池)工作原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时K+移向碳电极 | |
| B. | 放电时电池负极的电极反应为H2-2e-═2H+ | |
| C. | 充电时镍电极的电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O | |
| D. | 该电池充电时将碳电极与电源的正极相连,发生氧化反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定温度下,向饱和NaOH溶液中加入一小块钠,充分反应后恢复到原来温度,溶液的pH不变,有氢气放出 | |
| B. | 已知钡的活动性处于钾和钠之间,则在溶液中钡离子可氧化金属锌,使之成为锌离子 | |
| C. | 研究小组通过实验探究Cu及其化合物的性质,将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 | |
| D. | 次氯酸钠是漂粉精的主要成分 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Zn与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | 金属铜与稀盐酸反应:Cu+2H+═Cu2++H2↑ | |
| C. | Ca(OH)2溶液与Na2CO3溶液反应:Ca2++CO${\;}_{3}^{2-}$═CaCO3↓ | |
| D. | 氧化铁与稀盐酸反应:Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
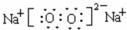 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com