
科目: 来源: 题型:选择题
| A. | 有机物都能燃烧生成二氧化碳和水,且受热不易分解 | |
| B. | 有机物大多数难溶于水而易溶于汽、四氯化碳等有机溶剂 | |
| C. | 有机物都是非电解质且熔点、沸点较低 | |
| D. | 有机化学反应都较复杂,且副反应多,反应速率慢 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液的pH变大 | |
| B. | c(Na+)与c(SO42-)的比值不变 | |
| C. | 电解过程中,向阳极附近溶液滴入酚酞,溶液变为红色 | |
| D. | 阴、阳极产生气体在相同条件下体积之比为1:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO32-+2I-+4H+ | |
| C. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | KOH═K++OH- | B. | NaHCO3?Na++HCO3- | ||
| C. | NH3•H2O?NH4++OH- | D. | CH3COOH?CH3COO-+H+ |
查看答案和解析>>
科目: 来源: 题型:解答题
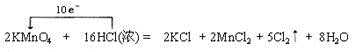 ,在该反应中氧化剂是KMnO4,氧化剂和还原剂的物质的量之比为1:5,产生标准状况下33.6LCl2时,转移电子的物质的量为3mol.
,在该反应中氧化剂是KMnO4,氧化剂和还原剂的物质的量之比为1:5,产生标准状况下33.6LCl2时,转移电子的物质的量为3mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com