
科目: 来源: 题型:填空题

 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 三种途径所消耗的铜的物质的量相等 | |
| B. | 三种途径所消耗的硝酸的物质的量相等 | |
| C. | 所消耗的铜的物质的量是:途径(3)>途径(1)>途径(2) | |
| D. | 所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
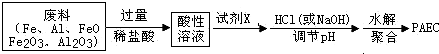
查看答案和解析>>
科目: 来源: 题型:解答题
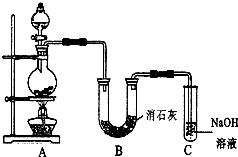 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应①是熵减小的反应,而反应②是熵增大的反应 | |
| B. | 反应②高温时能自发迸行.是由于生成CO2使熵值增大 | |
| C. | 上述事实说明的H2SiO3酸性有时比H2CO3强,有时比H2CO3弱 | |
| D. | H2CO3酸性强于H2SiO3,不能用反应②进行解释 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 断裂3NA个碳碳双键时,放出3260kJ的热量 | |
| B. | 消耗336L O2时,放出6520kJ的热量 | |
| C. | 转移30NA个电子时,放出3260kJ的热量 | |
| D. | 生成3NA个气态水分子时,放出3260kJ的热量 |
查看答案和解析>>
科目: 来源: 题型:解答题
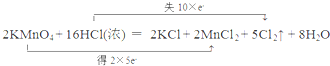
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com