
科目: 来源: 题型:选择题
| A. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| B. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| C. | 碳酸氢钠溶液中:K+、ClO-、Cl-、OH- | |
| D. | 使酚酞变红的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,5.6L SO3含有的分子数为0.25NA | |
| B. | 标况下,0.1mol苯中含有C=C键数目为0.3NA | |
| C. | 46g NO2和N2O4的混合气体中含有的原子个数为3NA | |
| D. | 7.8g过氧化钠与足量CO2反应,转移电子数为0.2NA,CO2为还原剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| B. | 明矾净水是因为Al(OH)3胶体能消毒 | |
| C. | MgO、Al2O3熔点高,它们都可用于制作耐火材料 | |
| D. | 高纯度的硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目: 来源: 题型:解答题
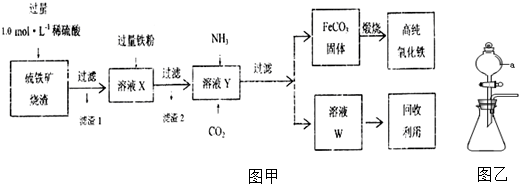
查看答案和解析>>
科目: 来源: 题型:解答题
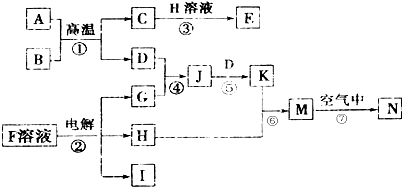
 ,N的化学式为Fe(OH)3.
,N的化学式为Fe(OH)3.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 单质是密度最小的气体 |
| M | 其单质为生命活动不可缺少的气体 |
| X | 短周期中原子半径最大的元素 |
| Y | 地壳中含量最高的金属元素 |
| Z | 最外层电子数是最内层电子数的3倍 |
| E | 单质为黄绿色气体 |
| 沸点 | 气态氢化物稳定性 | 最高价氧化物 对应水化物的碱性 | 得电子能力 |
| A2M>A2Z | Z< E | X> Y | 16M= 18M |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.4 mol•L-1 | B. | 1.0 mol•L-1 | C. | 0.7 mol•L-1 | D. | 0.5mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C2H5OH-12e-+12OH-═2CO2+9H2O | B. | O2+4H++4e-═2H2O | ||
| C. | O2+2H2O+4e-═4OH- | D. | C2H5OH+16OH--12e-═2CO32-+11H2O |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 2SO3(g)?2SO2(g)+O2(g)△H>0 | B. | N2(g)+3H2(g)?2NH3(g)△H<0 | ||
| C. | 4NH3(g)+5O2(g)?4NO+6H2O(g)△H<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CuSO4发生还原反应,白磷只作还原剂 | |
| B. | 氧化产物和还原产物的物质的量之比为6:5 | |
| C. | P4是一种正四面体型分子,每个P4分子中含有6个P-P非极性键 | |
| D. | 该反应中被硫酸铜氧化的白磷P4有3 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com