
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
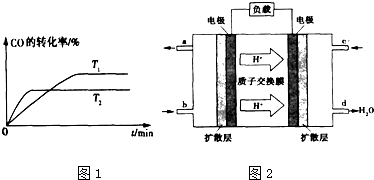
 ①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).
①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).查看答案和解析>>
科目: 来源: 题型:解答题
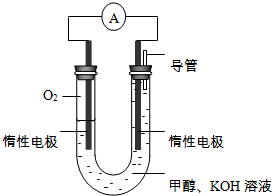
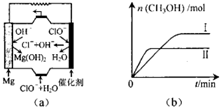 “低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.
“低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25% | B. | 50% | C. | 75% | D. | 无法计算 |
查看答案和解析>>
科目: 来源: 题型:解答题
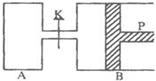 图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2molX、2molY,起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:
图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2molX、2molY,起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com