
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 整个过程中的还原剂只有I2 | |
| B. | CCl4层由紫色变成无色的化学反应方程式为:I2+5Cl2+6H2O=2HIO3+10HCl | |
| C. | 若用KI和Cl2反应制1molKIO3,至少需要56LCl2(标准状况) | |
| D. | 把 KI换成NBr,则CCl4层变为红棕色.继续滴加氯水,CCl4层的颜色没有变化,则Cl2、HIO3、HBrO3氧化性由弱到强的顺序是:HBrO3<Cl2<HIO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
 通过 NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法正确的是( )
通过 NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法正确的是( )| A. | Pt 电极上发生的是氧化反应 | |
| B. | O2-向正极迁移 | |
| C. | 负极的电极反应式为:NO-2e-+O2-=NO2 | |
| D. | 正极的电极反应式为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
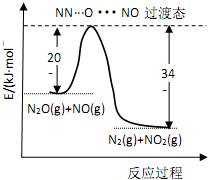 由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )| A. | 由图分析 N2O(g) 的能量一定高于 NO2(g)+N2(g) | |
| B. | 反应过程中没有发生化学键的断裂和化学键的生成 | |
| C. | 若生成 1mol N2(g),其△H=-139kJ•mol-1 | |
| D. | 由图可知 N2+NO2=N2O+NO△H=+139kJ•mol-1, 若使用催化剂还可以减小反应的热效应 |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )| A. | 腐蚀过程中,铜被氧化 | |
| B. | 已知环境中的 Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,则其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 4.29 g Cu2(OH)3Cl,则理论上耗氧体积定为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 粗铜板作阳极,电解硫酸铜溶液 | 粗铜溶解,纯铜在阴极上析出 | Cu 放电是氧化剂 |
| B | 向银氨溶液中滴加几滴乙醛后 水浴加热 | 银附着在试管壁上 | 乙醛发生还原反 应 |
| C | 向含 I-的无色溶液中滴加少量 新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向 FeSO4溶液中先滴入 KSCN 溶液再滴加 H2O2 溶液 | 加入 H2O2后溶液变成血红色 | Fe2+既有氧化性又 有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属氧化物一定是碱性氧化物 | |
| B. | SO2水溶液能导电,所以 SO2是电解质 | |
| C. | 胶体是纯净物,可以用丁达尔效应鉴别胶体和溶液 | |
| D. | 人们在认识事物时往往需要采用多种分类方法,来弥补单一分类方法的不足 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 L N2和 H2 混合气中含 NA个原子 | |
| B. | 3 mol 单质 Fe 完全转变为 Fe3O4,失去 8NA个电子 | |
| C. | 2 L 0.5 mol•L-1硫酸钾溶液中,含有 NA个阳离子 | |
| D. | 标准状况下,2128 mL 甲醛含有 2.85NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com