
科目: 来源: 题型:选择题
| A. | 油脂、乙酸乙酯都属于酯类,水解后都会生成乙醇 | |
| B. | 人的皮肤在强紫外线的照射下将会失去生理活性 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ③④⑤⑥ | C. | ①②⑤⑦ | D. | ①②⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  ? ?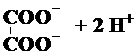 | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用水稀释0.1 mol/L的氨水,则溶液中$\frac{c(C{H}_{3}.{H}_{2}O)}{c(O{H}^{-})}$增大 | |
| B. | 在等体积等pH 的盐酸和醋酸两溶液中分别加入等质量的相同锌粒,若只有一种溶液中的锌粒有剩余,则该溶液一定是盐酸 | |
| C. | pH=3的盐酸和醋酸分别升高相同的温度,pH均不变 | |
| D. | 两种氨水溶液的物质的量浓度分别为C1和C2,pH分别为a和a+1,则C2=10C1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 | |||||
| (×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com