
科目: 来源: 题型:选择题
| A. | HCl | B. | Na2SO4 | C. | CuSO4 | D. | NaCl |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+、Mn${O}_{4}^{-}$、Cl-、${SO}_{4}^{2-}$ | B. | Na+、${CO}_{3}^{2-}$、${SO}_{4}^{2-}$、Cl- | ||
| C. | ${NO}_{3}^{-}$、Na+、${HCO}_{3}^{-}$、Mg2+ | D. | Na+、${NO}_{3}^{-}$、H+、${SO}_{4}^{2-}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 称量时,使用了游码,但砝码和药品放颠倒了 | |
| B. | 定容时俯视容量瓶刻度线 | |
| C. | 原容量瓶洗净后没有干燥 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |
查看答案和解析>>
科目: 来源: 题型:解答题
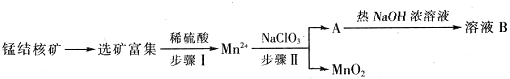
| 实验 | ① | ② | ③ | ④ |
| V(HNO3)/mL | 50 | 100 | 150 | 200 |
| V(NO)/L | 1.344 | 2.688 | 3.36 | 3.36 |
查看答案和解析>>
科目: 来源: 题型:解答题
 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 0.5mol/L盐酸 | B. | 自来水 | ||
| C. | 0.5mol/L硫酸 | D. | 0.5mol/L 氢氧化钡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com