
科目: 来源: 题型:选择题
| A. | 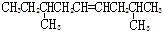 | B. | 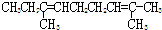 | ||
| C. | 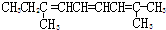 | D. | 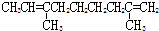 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 剩余固体是铁、铜混合物 | |
| B. | 反应后溶液中n (Fe2+)+n(Cu2+)=0.75 mol | |
| C. | 反应后溶液中n (Fe3+)=0.10 mol | |
| D. | 原固体混合物中铜的质量是8.0g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | O2和S2O32-是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1 mol Fe3O4,转移电子的物质的量为2 mol | |
| C. | 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol | |
| D. | 参加反应的氧化剂与还原剂的物质的量之比为1:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 向FeBr2溶液中通入足量 Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| D. | 向50 mL 1 mol•L-1明矾溶液中滴入两滴0.1 mol•L-1Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 电能全部转化为化学能 | B. | 粗铜接电源正极,发生氧化反应 | ||
| C. | 溶液中Cu2+向阳极移动 | D. | 利用阳极泥可回收Ag、Pt、Au等金属 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应均伴随着能量的变化 | |
| B. | 需要加热才能发生的反应不一定是吸热反应 | |
| C. | 物质的化学能可以在一定条件下转化为热能、电能为人类利用 | |
| D. | 吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com