
科目: 来源: 题型:选择题
| A. | a=10、b=9.2 | B. | a<10、b>9.2 | C. | a>10、b=9.2 | D. | a>10、b<9.2 |
查看答案和解析>>
科目: 来源: 题型:解答题

 +
+ $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$ (-R、-R’表示氢原子或烃基)用B和C为原料按如下路线合成A:
(-R、-R’表示氢原子或烃基)用B和C为原料按如下路线合成A:

 .
.
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入HNO3酸化的Ba(NO3)2溶液 | |
| B. | 先加入HNO3酸化,再加Ba(NO3)2 | |
| C. | 加入盐酸酸化的BaCl2 | |
| D. | 先用盐酸酸化,若有沉淀,则过滤,滤液中再加BaCl2溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题

 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$

 ;
; ;该反应的目的是保护在硝化过程中醇羟基不被氧化;
;该反应的目的是保护在硝化过程中醇羟基不被氧化; .
.查看答案和解析>>
科目: 来源: 题型:解答题
 (1)按已知的原子结构规律,27号元素在周期表中的位置是第四周期第Ⅷ族,其价电子的轨道排布图为
(1)按已知的原子结构规律,27号元素在周期表中的位置是第四周期第Ⅷ族,其价电子的轨道排布图为 .
. ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为4.
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为4. sp2
sp2 sp3
sp3

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

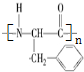 (写结构简式);
(写结构简式); ;
;查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为常见的气体,通入澄清石灰水中,石灰水变浑浊.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E元素在地壳中含量位居第四位,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为常见的气体,通入澄清石灰水中,石灰水变浑浊.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E元素在地壳中含量位居第四位,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:3 | D. | 1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com