
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 实验 混合溶液 |
A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目: 来源: 题型:
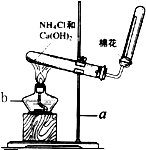 实验室常用下图装置制取氨气:请回答下列问题:
实验室常用下图装置制取氨气:请回答下列问题:
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞. ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 |
A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成淡黄色沉淀 |
| 实验方案 | 实验现象 | 有关离子方程式 |
③ ③ |
A | 2Na+2H2O=2Na++2OH-+H2↑ 2Na+2H2O=2Na++2OH-+H2↑ |
① ① |
B | 不填 |
⑤ ⑤ |
C | 不填 |
④ ④ |
D | 不填 |
② ② |
E | H2S+Cl2=2H++2Cl-+S↓ H2S+Cl2=2H++2Cl-+S↓ |
查看答案和解析>>
科目: 来源: 题型:
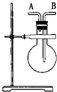 (1)如图,若烧瓶是干燥的.当烧瓶口向上时,由A口导入气体,可收集下列中的
(1)如图,若烧瓶是干燥的.当烧瓶口向上时,由A口导入气体,可收集下列中的查看答案和解析>>
科目: 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | =10 ⑩ | |||
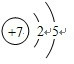
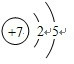


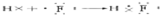
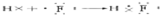
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com