
科目: 来源: 题型:选择题
| A. | 950mL 容量瓶 | B. | 500mL容量瓶 | ||
| C. | 1000mL 容量瓶 | D. | 任意规格的容量瓶 |
查看答案和解析>>
科目: 来源: 题型:解答题

| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1的硫酸铵溶液中:c(SO42->c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 1.0×l0-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 | |
| D. | 常温下,1mLpH=1的盐酸与l00mL pH=11的NaOH溶液混合后,溶液的pH=7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| ① | 由水电离的c(H+)=l×l0-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3- | |
| ② | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| ③ | Kw/c(H+)=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- | |
| ④ | FeCl2溶液:K+、Na+、SO42-、AlO2- |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. | 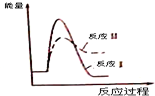 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 图甲表示使用催化剂后,该反应的△H变小 | |
| B. | 图乙表示反应NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.4kJ•mol-1反应的平衡常数随温度的变化 | |
| C. | 图丙表示反应H2(g)+I2(g)?2HI(g)中H2的转化率随压强的变化 | |
| D. | 图丁表示在饱和Na2SO4溶液中逐步加BaCO3固体后,溶液中c(${SO}_{4}^{2-}$)的浓度变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 某化学实验小组对钠与水的反应进行了研究,他们设计了如图所示的实验装置.请回答下列问题:
某化学实验小组对钠与水的反应进行了研究,他们设计了如图所示的实验装置.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com