
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
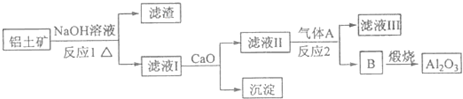

查看答案和解析>>
科目: 来源: 题型:解答题
| 时间/min | C(N2)/mol.L-1 | C(H2)/mol.L-1 | C(NH3)/mol.L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有① | B. | ①③⑤ | C. | ②④⑤⑥ | D. | ①③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 以NaOH溶液为电解液时,负极反应为Al+3OH--3e-═Al(OH)3↓ | |
| B. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-═4OH- | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 | |
| D. | 电池工作时,电子通过外电路从正极流向负极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为牺牲阳极的阴极保护法 | |
| B. | 原电池工作时,电流的方向由正极→负载→负极→原电池中电解质溶液→正极 | |
| C. | 白铁(镀锌铁)镀层破损后,铁皮依然受到保护 | |
| D. | 在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm~100nm之间 | |
| B. | 用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 | |
| D. | 树林中的晨曦,该现象与丁达尔效应有关 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O═2HNO3+NO | |
| B. | 用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3 (胶体)+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com