
科目: 来源: 题型:选择题
| A. |  比较非金属性强弱:S>C>Si 比较非金属性强弱:S>C>Si | B. |  分离CH3COOC2H5和饱和碳酸钠溶液 分离CH3COOC2H5和饱和碳酸钠溶液 | ||
| C. |  观察纯碱的焰色反应 观察纯碱的焰色反应 | D. |  比较Na2CO3和NaHCO3的热稳定性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 打磨磁石制作指南针为化学变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.查看答案和解析>>
科目: 来源: 题型:解答题
 工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁.
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁.查看答案和解析>>
科目: 来源: 题型:解答题
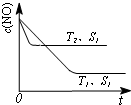 对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题: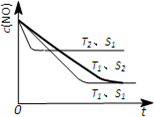 .
.查看答案和解析>>
科目: 来源: 题型:解答题
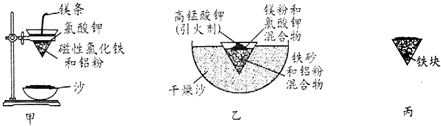
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E是原子序数依次递减的五种常见元素.C元素是地壳中含量最多的元素,D、E组成的气态化合物M的水溶液呈碱性,B的单质在C2中燃烧产物可使品红溶液褪色,A是一种历史悠久、应用广泛的金属元素.请回答:
A、B、C、D、E是原子序数依次递减的五种常见元素.C元素是地壳中含量最多的元素,D、E组成的气态化合物M的水溶液呈碱性,B的单质在C2中燃烧产物可使品红溶液褪色,A是一种历史悠久、应用广泛的金属元素.请回答: .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O2(s)与CO2(g)反应时,放出452kJ热量时,转移电子数为1.204×l023 | |
| B. | CO的燃烧热为△H=-566kJ/mol | |
| C. | CO(g)与Na2O2 (S)反应的热化学方程式为CO(g)+Na2O2(s)═Na2CO3(s)△H=-509kJ/mol | |
| D. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0 | B. | 32g | C. | 38.4g | D. | 48g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com