
科目: 来源: 题型:选择题
| A. | 1771年,法国科学家拉瓦锡发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系 | |
| B. | 化学科学与其他科学分支的联系不密切 | |
| C. | 化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 | |
| D. | 化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 新型材料纳米级铁粉与普通铁粉具有不同的性质.已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4.
新型材料纳米级铁粉与普通铁粉具有不同的性质.已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4.查看答案和解析>>
科目: 来源: 题型:解答题
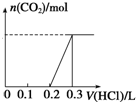 100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,
100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com