
科目: 来源: 题型:选择题
| A. | 奥运场馆“鸟巢”使用的代号为Q460的特殊钢是合金 | |
| B. | 乙醇是可再生的燃料,车用乙醇汽油值得提倡 | |
| C. | 复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能 | |
| D. | 含植物营养元素氮、磷的生活污水有利于水生植物成长,可以净化天然水体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应速率与I•的浓度有关 | B. | M是该反应的催化剂 | ||
| C. | 反应①与②的活化能相等 | D. | v(H2)=v(I2)=v(HI) |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 有A、B、C、D、E、F六种短周期元素,其中A 的一种原子不含中子;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;C元素的一种气体单质呈蓝色,D与B同周期,该周期中D的简单离子半径最小;E的单质是一种本身有毒可以用来消毒的气体;F 元素最高正价与最低负价的代数和为4.
有A、B、C、D、E、F六种短周期元素,其中A 的一种原子不含中子;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;C元素的一种气体单质呈蓝色,D与B同周期,该周期中D的简单离子半径最小;E的单质是一种本身有毒可以用来消毒的气体;F 元素最高正价与最低负价的代数和为4. .
.查看答案和解析>>
科目: 来源: 题型:解答题
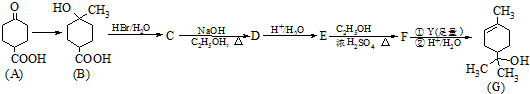
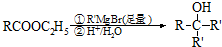
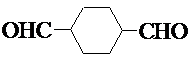 .
.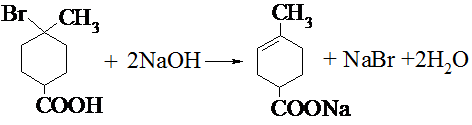 .
.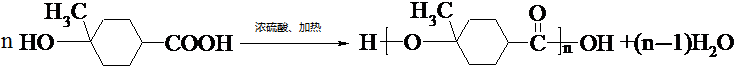 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
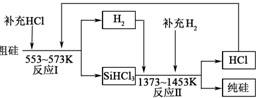 硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.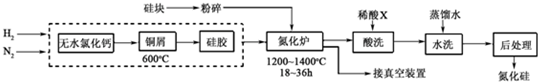
查看答案和解析>>
科目: 来源: 题型:解答题

| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
查看答案和解析>>
科目: 来源: 题型:解答题
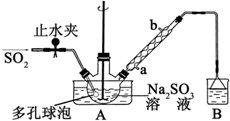 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com