
科目: 来源: 题型:填空题





查看答案和解析>>
科目: 来源: 题型:填空题
 .已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:共用电子对偏向F而偏离N原子,使得N原子上的孤对电子难于与Cu2+形成配位键.
.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:共用电子对偏向F而偏离N原子,使得N原子上的孤对电子难于与Cu2+形成配位键.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该绿色晶体配体是氯离子和水,它们物质的量之比为1:5 | |
| B. | 紫色晶体配合物的化学式为[Ti(H2O)6]Cl3 | |
| C. | 上述两种晶体的分子式相同,但结构不同,所以性质不同 | |
| D. | 0.01mol 紫色晶体在水溶液中与过量AgNO3作用最多可得到 2.78 g 沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题

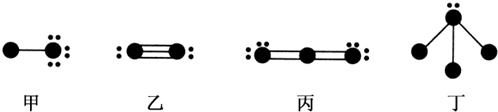
| A. | 通常状况下在水中溶解度丙大于丁 | |
| B. | 甲、乙、丙为非极性分子,丁为极性分子 | |
| C. | 甲的水溶液中存在4种氢键 | |
| D. | 甲中电负性小的元素与丙中电负性大的元素形成的化合物一定不存在极性键 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 已知大多数含氧酸可用通式XOm(OH)n来表示,H2SeO3、HMnO4、H3BO3、H3PO4 四种酸中酸性最强的是H2SeO3 | |
| B. | HF的沸点比H2O低是因水中氢键的键能比氟化氢中氢键能大 | |
| C. | 向加入过量氨水的硫酸铜溶液中加入乙醇,将析出深蓝色晶体来,是因为乙醇分子极性比水小 | |
| D. | H2CO3分子中的非羟基氧的个数为1,然而其酸性较弱,原因是溶于水的二氧化碳分子只有极少数与水结合成碳酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 编号 | ① | ② | ③ | ④ |
| 物质 | AlF3 | AlCl3 | BCl3 | NCl3 |
| 熔点/℃ | 1291 | 160 | -107 | -40 |
| A. | BCl3、NCl3分子中各原子最外层都满足8电子稳定结构 | |
| B. | NCl3中心原子价层电子对数比BCl3中心原子价层电子对数多 | |
| C. | AlF3、AlCl3都是强电解质,但晶体类型不同 | |
| D. | BCl3为平面正三角形分子,故它是由极性键构成的非极性分子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢键有方向性和饱和性,属于共价键 | |
| B. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 范德华力是一种分子间作用力,也是一种特殊的化学键 | |
| D. | 常温常压下,卤素单质从F2→I2由气态、液态到固态的原因是范德华力逐渐增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第一电离能:Y>X>Z>W | B. | 原子半径:W>X>Z>Y | ||
| C. | 电负性:Y>W>X>Z | D. | 最高正化合价:Y>W>X>Z |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 共价单键都是σ键,共价双键中有一个σ键和一个π键 | |
| B. | σ键可以绕键轴旋转,π键一定不能绕键轴旋转 | |
| C. | H2 分子中的σ键是s-s σ键,HClO分子中的σ键是p-p σ键 | |
| D. | C2H4分子中有5个σ键和一个π键,N2H4中只有5个σ键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com