
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝锂合金是铝与锂形成的一种化合物 | |
| B. | 锂是碱金属元素,性质活泼,铝锂合金与水反应生成氢气 | |
| C. | 铝离子和锂离子的核外电子排布相同 | |
| D. | 若铝锂合金中锂含量为1.1%,则127.3g铝锂合金中含有锂原子0.2mol |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
 A、B、C三个城市全年雨水的月平均pH变化如图所示.
A、B、C三个城市全年雨水的月平均pH变化如图所示.查看答案和解析>>
科目: 来源: 题型:填空题


查看答案和解析>>
科目: 来源: 题型:填空题
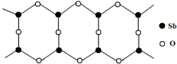

查看答案和解析>>
科目: 来源: 题型:填空题
| A.元素原子的核外p电子总数比s电子总数少1 |
| B.元素价电子排布式为nsnnp2n |
| C.元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| D.原子核外所有p轨道全满或半满 |
| E.元素的主族序数与周期数的差为4 |
| F.是前四周期中电负性最小的元素 |

 ;1mol B22+中含有的π键数目为2NA.
;1mol B22+中含有的π键数目为2NA.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com