
科目: 来源: 题型:填空题
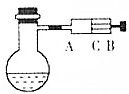 如图所示,在烧瓶中盛饱和氯水,并滴有酚酞溶液,试填写以下空白:
如图所示,在烧瓶中盛饱和氯水,并滴有酚酞溶液,试填写以下空白:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
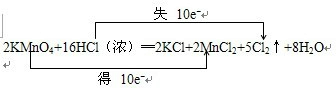 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4L H2含有的分子数为NA | |
| B. | 标准状况下,80g SO3的体积为22.4L | |
| C. | 18g H2O在标准状况下的体积是22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 16g CH4所含原子数目为NA | |
| C. | 1mol氦气中有2NA个氦原子 | |
| D. | 2L 0.3mol•L-1 Na2SO4溶液中含1.2NA个Na+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
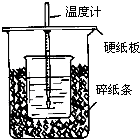 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com