
科目: 来源: 题型:选择题
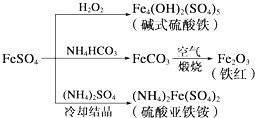
| A. | 制备碱式硫酸铁利用了过氧化氢的氧化性 | |
| B. | 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 | |
| C. | 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 | |
| D. | 制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目: 来源: 题型:解答题
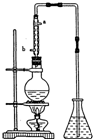 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$ n(C2H4O)
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$ n(C2H4O) .
.查看答案和解析>>
科目: 来源: 题型:解答题
 已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出).请回答上述实验室制备苯甲酸乙酯的有关问题:
已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出).请回答上述实验室制备苯甲酸乙酯的有关问题:查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
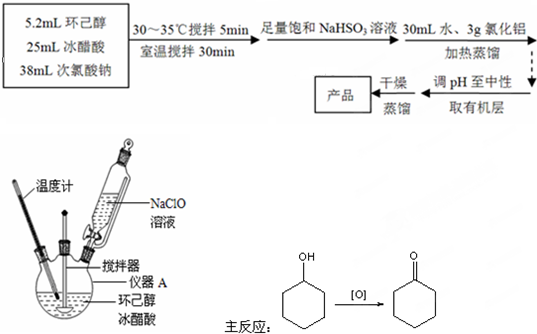
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:| 沸点/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com