
科目: 来源: 题型:解答题
 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
科目: 来源: 题型:解答题
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程:
某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程:查看答案和解析>>
科目: 来源: 题型:选择题
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| B. | 500s内N2O5分解速率为2.96×10-3mol•L-1•s-1 | |
| C. | 达平衡后其他条件不变,将容器的体积压缩到原来的 $\frac{1}{2}$,则c(N2O5)>5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% |
查看答案和解析>>
科目: 来源: 题型:多选题
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n(N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | T1温度下,CH4的平衡转化率为50% | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时反应的平衡常数大于T1时反应的平衡常数 |
查看答案和解析>>
科目: 来源: 题型:解答题
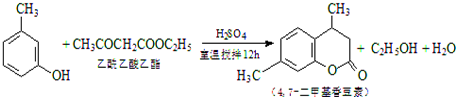
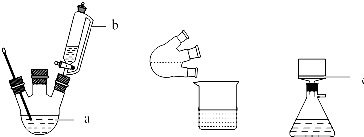
 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10% | B. | 20% | C. | 30% | D. | 40% |
查看答案和解析>>
科目: 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(I2)/mol | 0.012 | 0.011 | 0.010 | 0.010 |
查看答案和解析>>
科目: 来源: 题型:解答题
 “低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.
“低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所 需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | tm |
| III | 900 | 2 | 4 | y | y | tn |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com