
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| B. | 12.4g白磷晶体中含有的P-P键数是0.1NA | |
| C. | 2mol SO2和1mol O2混合在V2O5存在的条件下,密闭容器中加热反应后,容器内物质的分子数大于2NA | |
| D. | 将NO2和N2O4分子共NA个降温至标准状况下,其体积为22.4 L |
查看答案和解析>>
科目: 来源: 题型:解答题
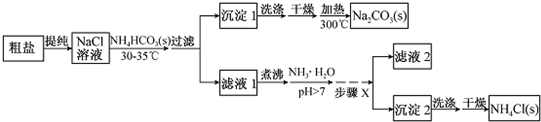
查看答案和解析>>
科目: 来源: 题型:解答题
 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
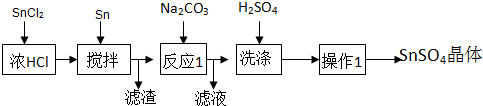
查看答案和解析>>
科目: 来源: 题型:填空题
 将0.8mol I2(g)和1.2mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)并达到平衡.HI的体积分数随时间的变化如表格所示:
将0.8mol I2(g)和1.2mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)并达到平衡.HI的体积分数随时间的变化如表格所示:| HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
| 条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
| 条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.6 | 0.6 |
| A. | 该反应的平衡常数表达式为:K=[c(CH3OCH3)×c(H2O)]/c(CH3OH) | |
| B. | 此时正、逆反应速率的大小:v正<v逆 | |
| C. | 若加入CH3OH后,经10 min达到平衡,此时c(CH3OH)=0.04 mol/L | |
| D. | 10 min达到平衡时,反应速率v(CH3OH)=1.6 mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com