
科目: 来源: 题型:选择题
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | 次氯酸钙溶液中通入过量的二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 少量NaHSO4与过量Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | ③④⑦⑧ | B. | ①②③④ | C. | ⑤⑥⑦⑧ | D. | ③④⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加热,观察是否有气体放出 | |
| B. | 加入盐酸,观察是否有气体放出 | |
| C. | 溶于水后加BaCl2溶液,观察有无沉淀出现 | |
| D. | 进行焰色反应,观察火焰是否呈黄色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H+、Na+、SO42-、HCO3-? | B. | Mg2+、K+、SO42-、OH- | ||
| C. | K+、Na+、Fe3+、NO3- | D. | Ba2+、OH-、NO3-、Na+ |
查看答案和解析>>
科目: 来源: 题型:解答题
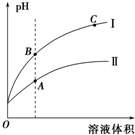 已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:| 醋酸 | 碳酸 | 亚硫酸 |
| Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应过程中既有物质变化又有能量变化,能量的释放或吸收以物质变化为基础 | |
| B. | 研究化学反应进行的方向、快慢和限度是化学反应原理的重要内容 | |
| C. | 电解质在水溶液中的反应反应速率很高,是因为这类反应不需要活化能来引发 | |
| D. | 大力发展火电以满足工业发展对电力的需求,符合节能减排的要求 |
查看答案和解析>>
科目: 来源: 题型:解答题
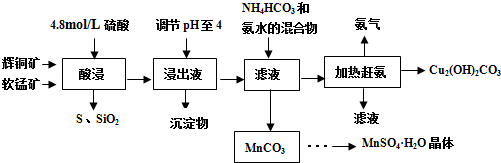
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com