
科目: 来源: 题型:选择题
| A. | 该反应是吸热反应 | |
| B. | 反应的△H与各物质的状态有关,与化学计量数也有关 | |
| C. | 由方程式可知,CH4的燃烧热为802.3 kJ•mol-1 | |
| D. | 该式的含义为:25℃、101 kPa下,1molCH4气体完全燃烧生成CO2和液态水时放出热量802.3kJ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu2+、C1-、SO42-、K+ | B. | K+、OH-、CO32-、Fe2+ | ||
| C. | Ca2+、OH-、C1-、Na+ | D. | Ag+、NO3-、Cl-、K+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHSO4=Na++H++SO42- | B. | Ba(OH)2=Ba2++2OH- | ||
| C. | CaCO3=Ca2++CO32- | D. | KHCO3=K++H++CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molAl3+离子含有的电子数为3NA | |
| B. | 1molCl2含有1 NA个原子 | |
| C. | 23g钠在22.4L(标况下)Cl2中反应,转移电子数NA个 | |
| D. | 欲配制1.00L 1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 g•mol-1 | |
| B. | 2mol NO和2mol N2气体体积相等 | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 等物质的量的CO和CO2中所含碳原子数相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
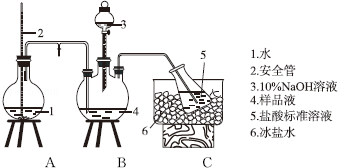
查看答案和解析>>
科目: 来源: 题型:解答题
 如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理.B在实验时才插入溶液中.
如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理.B在实验时才插入溶液中.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | p(Br2)≤4.66×103Pa | B. | 2.33×103Pa<p(Br2)≤4.66×103Pa | ||
| C. | <p(Br2)>2.33×103Pa | D. | 2.33×103Pa≤p(Br2)≤4.66×103Pa |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com