
科目: 来源: 题型:选择题
| A. | 2NaCl(熔融)=2Na+Cl2↑ | B. | WO3+3H2 $\frac{\underline{\;△\;}}{\;}$ W+3H2O | ||
| C. | Fe+CuSO4=Cu+FeSO4 | D. | 2Ag2O $\frac{\underline{\;△\;}}{\;}$4Ag+O2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 46 g乙醇中含有的化学键数为7NA | |
| B. | 1 mol OH-和1 mol-OH含有的电子数均为10NA | |
| C. | 标准状况下,6.72 L NO2和水充分反应转移电子数为0.2NA | |
| D. | 常温常压下,28 g 乙烯分子中共含有2NA对共用电子对 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 废弃的电池应分类回收,不要随意丢弃.否则,既造成浪费又污染环境 | |
| C. | PM2.5(2.5微米以下的颗粒物)的污染与化石燃料的燃烧关系不大 | |
| D. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 |
查看答案和解析>>
科目: 来源: 题型:选择题
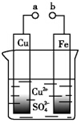
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Cu2++2e Cu Cu | |
| C. | a和b用导线连接时,Fe为负极,Cu为正极,化学能转化为电能 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 电解Al2O3得到Al和O2 | B. | HCl分解为H2和Cl2 | ||
| C. | Al和Fe2O3在高温条件下反应 | D. | Ba(OH)2•8H2O和NH4Cl晶体混合反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| B. | 糖类、油脂、蛋白质都是天然的高分子化合物 | |
| C. | 植物油能使溴水褪色,氢化(加氢)可以变为脂肪 | |
| D. | 淀粉、蛋白质溶液均匀、稳定,不产生丁达尔效应 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com