
科目: 来源: 题型:解答题

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 +
+ $\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$
$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$ +H2O
+H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |

查看答案和解析>>
科目: 来源: 题型:解答题
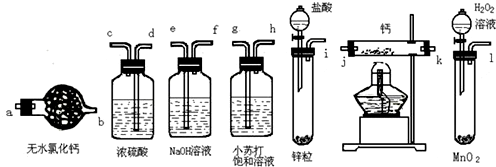
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 以B表示的平均反应速率为v(B)=0.13mol•L-1•min-1 | |
| B. | 4min时,A的物质的量为0.75mol | |
| C. | 该反应方程式中,x=2 | |
| D. | 4min时,A的转化率为60% |
查看答案和解析>>
科目: 来源: 题型:解答题
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.30 | 0.30 | 0.30 |
查看答案和解析>>
科目: 来源: 题型:填空题
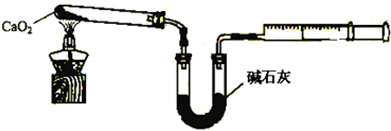
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com