
科目: 来源: 题型:选择题
| A. | 2Na2O2+2N2O3═4NaNO2+O2 | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | Na2O2+N2O5═2 NaNO3+O2 | D. | 2Na2O2+2Mn2O7═4NaMnO4+O2 |
查看答案和解析>>
科目: 来源: 题型:选择题
 下列各组物质中,物质之间通过一步反应能实现图示变化的是( )
下列各组物质中,物质之间通过一步反应能实现图示变化的是( )| 物质组编号 | a | b | c | d |
| ① | CO2 | CO | C | CaCO3 |
| ② | Na2CO3 | NaOH | Na2O2 | NaHCO3 |
| ③ | FeCl3 | FeCl2 | Fe | CuCl2 |
| ④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| A. | ①②③ | B. | ②③④ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH3能氧化氮氧化物,可用于汽车尾气净化 | |
| B. | Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 | |
| C. | Fe在氧气中的燃烧产物可用于制红色涂料 | |
| D. | Mg(OH)2分解吸热且生成高熔点固体,可作阻燃剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠不慎着火,可用泡沫灭火器来灭火或湿布盖灭 | |
| B. | 往FeCl3溶液中滴入KI淀粉溶液,溶液变蓝色 | |
| C. | 铝粉和MgO或Cr2O3粉末混合,高温能发生铝热反应 | |
| D. | 向紫色石蕊试液中加入Na2O2粉末,振荡后溶液变为蓝色并产生气泡 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上生产水泥、玻璃、陶瓷,均需要用石灰石为原料 | |
| B. | 石英是良好的半导体材料,可以制成光电池,将光能直接转化为电能 | |
| C. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物 | |
| D. | 地沟油由于混有一些对身体有害的杂质而不能食用,可加工制成生物柴油,生物柴油的成分与从石油中提取的柴油成分不同 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
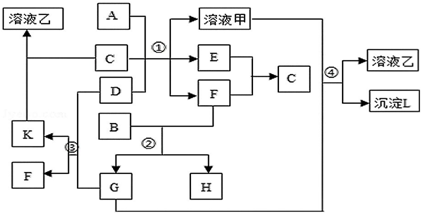
查看答案和解析>>
科目: 来源: 题型:解答题
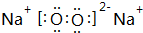
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com