
科目: 来源: 题型:选择题
| A. | 1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol臭氧和1.5 mol氧气含有相同的氧原子数 | |
| C. | 标准状况下,22.4LO2含分子数为NA | |
| D. | 标准状况下,8gH2O的体积是22.4L |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$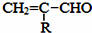
 的相对分子质量大2,则符合下列条件的G的同分异构体有3种.
的相对分子质量大2,则符合下列条件的G的同分异构体有3种. 的合成路线
的合成路线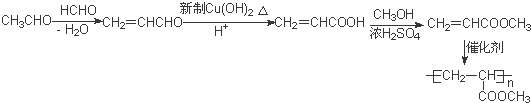 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol乙烯分子中含有的共价键数目为4NA | |
| B. | 2L 0.5mol•L-1(NH4)2SO4溶液中NH4+离子总数为2NA | |
| C. | 1mol FeBr2与足量氯气反应时,转移的电子数为3NA | |
| D. | 1mol Na2O2固体中含离子总数为4NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯的最简式(实验式)为:C2H4 | B. | 乙醇的结构简式为:C2H6O | ||
| C. | 醛基的简写方式为:-CHO | D. | 苯分子中既有单键又有双键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 凡是含碳元素的化合物都属于有机物 | |
| B. | 所有的有机物都很容易燃烧 | |
| C. | 有机物不一定都不溶于水 | |
| D. | 易溶于酒精、苯等有机溶剂中的物质一定是有机物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com