
科目: 来源: 题型:解答题
 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色
查看答案和解析>>
科目: 来源: 题型:解答题
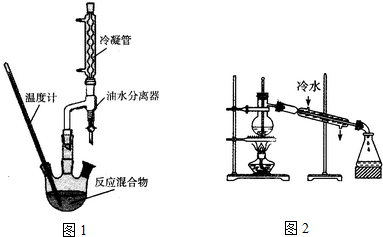
 乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下:
乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下: +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$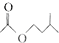 +H2O
+H2O| 相对分子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙醇 | 60 | 1.0492 | 118 | 溶 |
| 乙醇异戊酯 | 130 | 0.8670 | 142 | 难溶 |

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
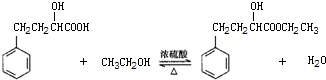
| 相对分子量 | 密度(g/cm3) | 沸点(℃) | 水溶性 | |
| 2-羟基-4-苯基丁酸 | 180 | 1.219 | 357 | 微溶 |
| 乙 醇 | 46 | 0.789 | 78.4 | 易溶 |
| 2-羟基-4-苯基丁酸乙酯 | 208 | 1.075 | 212 | 难溶 |
查看答案和解析>>
科目: 来源: 题型:解答题
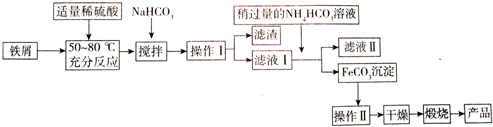
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 沉淀完全 | 3.2 | 9.7 | 4.4 |

查看答案和解析>>
科目: 来源: 题型:解答题
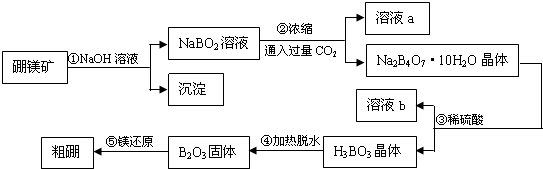
查看答案和解析>>
科目: 来源: 题型:解答题

| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
| 相对分子质量 | 106 | 102 | 148 | 60 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com