
科目: 来源: 题型:解答题
 如图的实验装置可用于实验室中制取乙炔.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④ | B. | ③⑤⑥ | C. | ②③⑥ | D. | ①④⑤ |
查看答案和解析>>
科目: 来源: 题型:解答题
 CH3COOCH2CH3+H2O,属于酯化(取代)反应.
CH3COOCH2CH3+H2O,属于酯化(取代)反应.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 1种 | B. | 2种 | C. | 3 种 | D. | 4种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化铝与盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 碘化钾溶液中滴入溴水:2I-+Br2═I2+2Br- | |
| D. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+3OH-═AlO2-+3H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
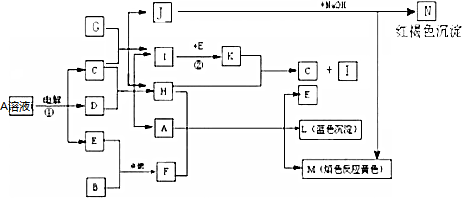
 ,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目
,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇是一种重要燃料,在电化学领域有着重要的用途.
甲醇是一种重要燃料,在电化学领域有着重要的用途.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com