
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
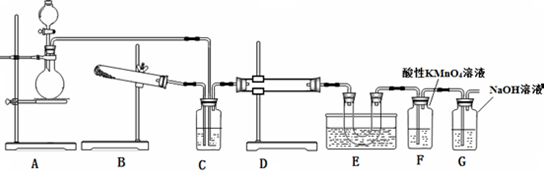
 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯,有关物质的物理性质见表:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯,有关物质的物理性质见表:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 浓度/g•cm3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

查看答案和解析>>
科目: 来源: 题型:解答题
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O查看答案和解析>>
科目: 来源: 题型:解答题
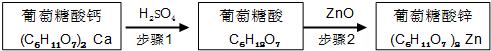
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

查看答案和解析>>
科目: 来源: 题型:填空题
 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].查看答案和解析>>
科目: 来源: 题型:解答题
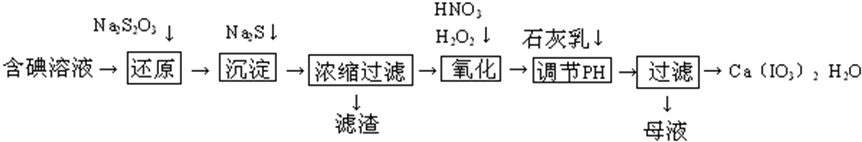
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com