
科目: 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
 硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐.
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐.| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:解答题



查看答案和解析>>
科目: 来源: 题型:解答题
 草酸是一种重要的化工原料,常用于有机合成,它属于二元弱酸,易溶于乙醇、水、微溶于乙醚.以甘蔗碎渣(主要成分为纤维素)为原料制取草酸的工艺流程如下:
草酸是一种重要的化工原料,常用于有机合成,它属于二元弱酸,易溶于乙醇、水、微溶于乙醚.以甘蔗碎渣(主要成分为纤维素)为原料制取草酸的工艺流程如下:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 实验室制备 1,2-二溴乙烷的反应原理如下:
实验室制备 1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
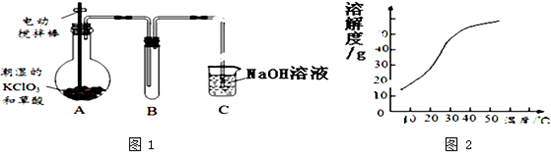
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com